
1901 - 1994
Linus Carl Pauling foi um químico quântico e bioquímico dos Estados Unidos. Também é reconhecido como cristalógrafo, biólogo molecular e pesquisador médico.
Pauling é amplamente reconhecido como um dos principais químicos do século XX.
Prêmios Nobel de Química(1954), Nobel da Paz por sua militância contra as armas nucleares (1962) e Medalha Priestley (1984)
Demais Obras: Como viver mais e melhor: o que os médicos não dizem sobre sua saúde, A vitamina C, o resfriado comum e a gripe.
1887 - 1961
 Segundo o cientista Schrödinger,
cada elétron da eletrosfera de um
átomo possui uma determinada quantidade de energia. Assim, cada elétron só permanece no nível e subnível de energia correspondente. A distribuição desses elétrons em seus níveis e subníveis de energia é feita na forma de energia.
Segundo o cientista Schrödinger,
cada elétron da eletrosfera de um
átomo possui uma determinada quantidade de energia. Assim, cada elétron só permanece no nível e subnível de energia correspondente. A distribuição desses elétrons em seus níveis e subníveis de energia é feita na forma de energia.
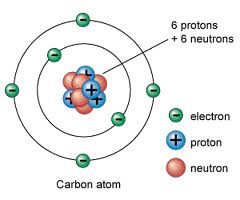
Representação Gráfica do Átomo de Carbono. No Núcleo se encontra a massa do átomo, que é composta de 6 Prótons e 6 Neutróns e ao redor encontramos os elétrons que são a energia do átomo.
A representação gráfica da distribuição dessa energia em níveis e subníveis é representada pelo Diagrama de Pauling, criado pelo químico Linus Pauling.

Para os elementos químicos conhecidos até hoje, o diagrama de Pauling representa os níveis que são as camadas eletrônicas do átomo denominadas pelas letras
K, L, M, N, O, P e Q
e cada letra representada por um número quântico principal (n), que assume valores de 1 a 7 como representado abaixo onde temos os núcleo e a indicação das camadas de energia:

A distribuição eletrônica (ou seja distribuição dos elétrons) é feita de acordo com a capacidade de cada camada e de acordo com a capacidade de cada um dos quatro sub nível existente que são:
s, p, d, f
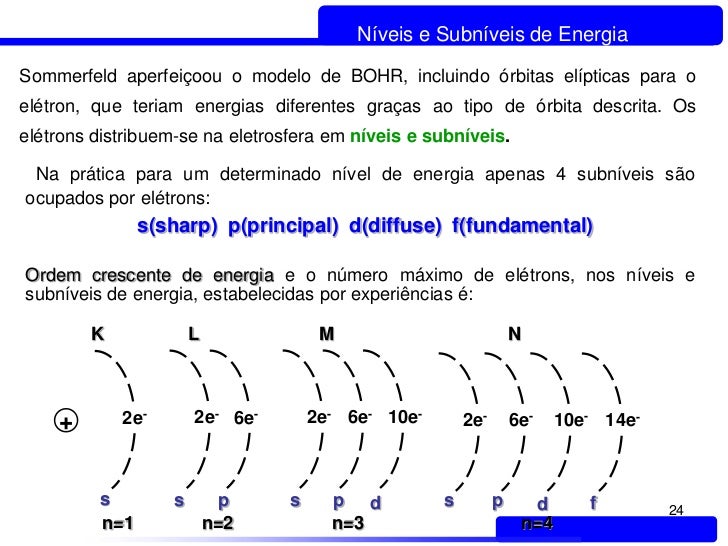
A quantidade de subníveis existentes em cada nível está esboçada abaixo:

Relacionando os níveis e os subníveis, obtemos o diagrama de eletrosferas representado acima.
A quantidade máxima de elétrons que pode ser distribuída em cada nível e subnível está evidenciada a seguir:



Visto que, para um mesmo nível, os subníveis têm energias diferentes, nem sempre o subnível energético é o mais afastado do núcleo. Por isso, é importante seguir a ordem crescente de energia dos subníveis no momento de fazer a distribuição dos elétrons. Essa ordem é dada pelas setas indicadoras no Diagrama de Pauling:

A representação gráfica da distribuição eletrônica é dada pelo Diagrama de Pauling.
Portanto, veja exemplos de distribuição dos elétrons de dois elementos químicos da tabela periódica:
Exemplo 1: Magnésio - Mg - elemento número 12 da tabela Periódica.
Ordem energética da distribuição eletrônica do Mg: 1s2, 2s2, 2p6 e 3s2.
Ordem energética da distribuição eletrônica do Mg: 1s2, 2s2, 2p6 e 3s2.

Exemplo 2: Vanádio-V elemento número 23 da tabela periódica.
Ordem energética da distribuição eletrônica do 23V: 1s2, 2s2, 2p6,3s2, 3p6, 4s2 e 3d3.

Observe que, nesse exemplo, no último subnível preenchido (3d) cabem 10 elétrons, porém apenas 3 foram necessários para completar o número atômico.
Tabela Periódica


Nenhum comentário:
Postar um comentário